Histórico regulatório das nitrosaminas no Brasil
Desde 2018 a Anvisa vem se alinhando às agências regulatórias internacionais como Agência de Alimentos e Medicamentos dos Estados Unidos (FDA) e a Agência Europeia de Medicamentos (EMA) mediante os riscos apresentados pelas nitrosaminas, principalmente em medicamentos da classe de Antagonistas dos Receptores de Angiotensina II.
As nitrosaminas são um grupo de compostos com elevada toxicidade e potencial carcinogênico. Se você ainda não as conhece, dê uma olhada nesse artigoaquie fique por dentro!
Em 2019, iniciaram-se medidas em prol da limpeza e redução de nitrosaminas em medicamentos. E em maio, passou a ser válida aRDC 283/2019 que estabelece regras para investigação, controle e eliminação de nitrosaminas. Sendo aplicada em empresas fabricantes, importadoras e fracionadoras de insumos farmacêuticos; empresas fabricantes e importadoras de medicamentos; e farmácias com manipulação.
O foco dessas resolução são os medicamentos conhecidos como “sartanas”, geralmente usados para controle de pressão alta. Posteriormente foram detectadas nitrosaminas em outras classes de medicamentos, que por enquanto ainda seguem sem resoluções específicas.
De 2019 a 2020, a Anvisa recolheu cerca de 200 lotes de medicamentos da classe das “sartanas” e suspendeu a fabricação, importação, distribuição, comercialização e uso dos insumos farmacêuticos ativos com suspeita de contaminação. Totalizando 14 suspensões de 3 insumos (losartana, valsartana e irbesartana) de fabricantes internacionais.
Anvisa lança primeiro programa de monitoramento para nitrosaminas
Em Setembro de 2020, a Anvisa lançou o primeiro Programa Especial de Monitoramento de Nitrosaminas em Medicamentos em parceria com o Instituto Nacional de Controle de Qualidade (INCQS/Fiocruz). Visando aprofundar as investigações sobre a presença de impurezas do tipo nitrosamina em Insumos Farmacêuticos Ativos (IFAs) e fármacos, complementando as medidas daRCD 283/2019.
O programa manteve as inscrições abertas durante 1 ano e as encerrou em setembro deste ano. As empresas interessadas poderiam se associar e colaborar enviando amostras de seus medicamentos para serem submetidos por análises em busca e quantificação de nitrosaminas. Ele acontece em duas etapas:
Etapa 1:
Envio voluntário de amostras, previamente documentadas, de medicamentos e IFAS (do tipo losartana e valsartana) ao INCQS para a identificação de quantificação de nitrosaminas.
Etapa 2:
As amostras desses e de outros produtos passam por análises feitas pela Anvisa e pelos demais órgãos locais de vigilância sanitária, de acordo com o previsto naLei 6.437/1977.
Desde então, a Anvisa elaborou e emitiu a primeira versão do “Guia sobre o Controle de Nitrosaminas em Insumos Farmacêuticos Ativos e Medicamentos”. Este documento apresenta recomendações quanto ao controle de nitrosaminas em todos os IFAs sintetizados quimicamente e medicamentos para uso humano que os contenham, incluindo produtos biológicos, quando cabível.
O Guia nº 50/2021 da Anvisa norteia o controle de nitrosaminas em IFAs e medicamentos.
As recomendações são igualmente aplicáveis para alterações pós-registro que possam resultar em formação de nitrosaminas, como mudanças relacionadas ao IFA, à composição e à embalagem do medicamento, dentre outras.
Por meio do guia, a Anvisa sugere que a análise de gerenciamento de risco seja realizada em três etapas:
Consiste na identificação e avaliação do risco, sugere ser iniciada pela rota de síntese do IFA e inclui qualquer via que possa introduzir nitrosaminas. Avaliando em conjunto o processo de fabricação, embalagem, armazenamento e processo de degradação.
Ainda é sugerido que as empresas utilizem os princípios descritos no Guia ICH Q9 – Quality Risk Management (ICH 2005) como suporte para a realização das análises de risco.
Caso o IFA ou medicamento apresente risco de presença de nitrosaminas, ele prossegue para a etapa 2.
Validar ou refutar a presença de nitrosaminas por meio de testes analíticos sensíveis e devidamente validados, priorizando sempre a categoria de risco do produto. É considerado ausência de nitrosaminas quando o resultado da análise for inferior ao limite de detecção do método, não sendo este maior que 0,03ppm.
Confirmada a presença da impureza em níveis acima do aceitável, os responsáveis legais dos produtos devem protocolar junto à Anvisa a solicitação de recolhimento voluntário, em conformidade com a ResoluçãoRDC 55/2005 e suas atualizações. Ainda se deve avaliar o risco da ingestão pelos pacientes e tomar as ações apropriadas para evitar ou minimizar a exposição dos indivíduos às nitrosaminas.
Após a etapa de quantificação, a empresa deve protocolar junto à Agência, caso aplicável, as respectivas petições pós-registro em conformidade com a ResoluçãoRDC 73/2016 para medicamentos.
A fim de mitigar o risco da presença de nitrosaminas, algumas alterações e testes pós-registros são incluídos e podem ser aplicáveis. Os testes são de implementação ou notificação imediata e realizados mediante código de assunto específico.
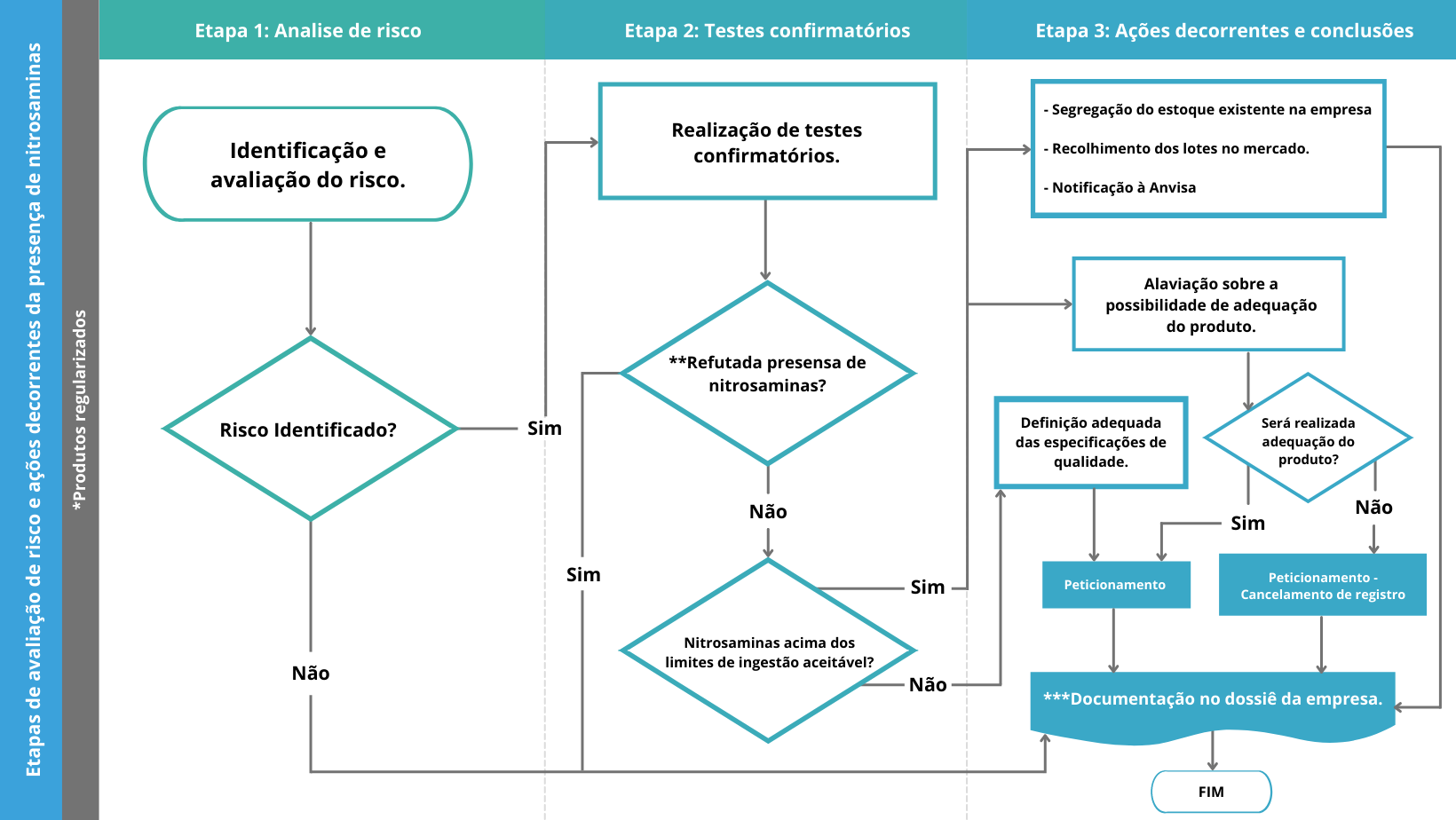
- * Medicamentos e insumos farmaceuticos ativos (IFAs) registrados, notificados ou cadastrados.
- ** Considera-se ausência de nitrosaminas quando está estiver abaixo de 10% do limite de ingestão aceitável. Outras abordagens podem ser justificadas, não excedendo o limite de 30%.
- *** Esses dados poderão ser solicitados ou inspecionados in loco,a critério da Anvisa.
- Fonte: adaptado da Anvisa.
O prazo está acabando
Em Abril de 2021, em alteração aRDC 283/2019, a Anvisa emitiu aRDC 494/2021 a qual decretou o prazo para a ausência de nitrosaminas em IFAs e medicamentos prontos ainda este ano. Pouco menos de 3 meses para que as farmacêuticas submetam seus produtos às etapas regulatórias, incluindo casos que exigem a mudanças pós-registro sob provas no medicamento, estipulado pelaRDC 500/2021 emitida em Maio deste ano.
Para os casos pós-registros que solicitem relatórios de estabilidades, estes podem ser entregues ainda sob o formato de análises iniciais; sendo enviados completos imediatamente após o término dos testes.
“Art. 9º Não será aceitável a presença de nitrosaminas citadas nesta Resolução em IFA da classe dos antagonistas do receptor de angiotensina II, após 31/12/2021.”
“Art. 10 Nos casos em que a eliminação prevista no art. 9º implique na necessidade de mudanças pós-registro que requeiram provas no medicamento, estas devem ser protocoladas no prazo máximo de 31 de dezembro de 2021.”
Mediante o curto tempo para a realização de todas as etapas exigidas pela Anvisa, a busca por serviços de toxicologia regulatória tem aumentado consideravelmente, principalmente àqueles com atendimento ágil e facilitado.
Empresas que utilizam metodologias computacionais integradas são as mais cotadas, já que apresentam como grande benefício a redução de custos e tempo para a elaboração de suas documentações técnico-científicas, em comparação a outros métodos.
AInsilicAllpossui um time especializado nesse setor, atuando em todo processo de qualificação das nitrosaminas, além de contar com tecnologia de precisão e Inteligência Artificial que são empregadas no serviço de toxicologia regulatória oferecido.
Agende uma reunião conosco, fique por dentro de todos os nossos serviços e tenha suas demandas atendidas da forma mais segura possível!
Sobre a InsilicAll
Somos a primeira empresa LATAM que empodera a indústria farmacêutica em seus desafios de drug discovery e em toxicologia regulatória aplicando IA e automação biológica. Com nosso modelo SaaS aumentamos a taxa de sucesso de nossos clientes levando medicamentos inovadores para os pacientes de forma mais rápida e garantindo a segurança toxicológica de sua produção. Nossa missão de entregar a melhor tecnologia com o menor impacto (ESG) nos permite garantir para nossos clientes a otimização de tempo, custos e experimentação animal em seus processos.
Trabalhamos para aumentar a taxa de sucesso em levar medicamentos inovadores para as necessidades dos pacientes, diminuindo o cronograma, os custos e o tempo para que um novo produto chegue à sociedade. Para isso, nossa empresa integra IA, computação e automação biológica para acelerar o design de novas moléculas e proteínas terapêuticas.










