As N-nitrosaminas, que hoje popularmente chamamos apenas de nitrosaminas, tornaram-se objeto de intensos estudos toxicológicos nos últimos cinquenta anos, mais precisamente a partir de 1954, quando os cientistas britânicos Magee e Barnes ineditamente reportaram sobre a associação entre danos hepáticos em ratos e a N-nitrosodimetilamina (NDMA).
Dois anos mais tarde, os mesmos pesquisadores confirmaram a indução de tumores hepáticos em ratos que foram alimentados com NDMA. Na Noruega, na virada da década de 50 para 60, a hepatotoxicidade advinda das nitrosaminas foi, mais uma vez, confirmada em animais alimentados com rações tratadas com nitritos.
Em 2018, foram detectadas nitrosaminas nas classes das valsartanas. Nos anos subsequentes, diversas foram as recomendações emitidas pelos órgãos reguladores, EMA, FDA e Anvisa, movimentando-se no sentido de avaliar fármacos sintéticos e biológicos quanto a presença das nitrosaminas. No Brasil, após a divulgação das RDC 283, 494 e 500 que normatizam as nitrosaminas, a Anvisa lançou o Guia nº 50/2021 que auxilia indústrias farmacêuticas quanto às medidas que devem ser tomadas no caso.
As nitrosaminas são compostos derivados da reação entre um grupo nitroso (-NO) e um grupo amino (-NH2). Em outras palavras, são formadas pela associação de um conjunto de nitrogênio secundário (amina, amida, alquil-uréia ou um anel peptídeo) e um agente nitrosante (ácido nitroso, anidrido nitroso, tetróxido de dinitrogênio e óxido nítrico).
Comumente, as nitrosaminas são sintetizadas a partir do ácido nitroso (HNO2) e aminas secundárias. Aminas primárias e terciárias também podem gerar nitrosaminas, as feitas a partir de aminas primárias apresentam uma instabilidade maior do que as demais e não são tão comuns.
Elas são estáveis em meios neutros e fortemente básicos e, portanto, uma vez formadas são dificilmente destruídas. No entanto, se decompõem lentamente quando expostas à radiação ultravioleta formando aldeídos, nitrogênio e óxido nitroso, ou aminas e ácido nitroso. Em meio fortemente ácido ocorre ruptura do grupo nitroso, um dos reagentes comumente utilizados para destruir uma nitrosaminas é o ácido bromídrico em ácido acético glacial, a reação ainda pode ser catalisada pela presença de nucleófilos.
Sua fórmula estrutural genérica é R1-R2-N-N=O, onde o radical 1 (R1) e radical 2 (R2) podem ser grupos alquilas ou arilas. As propriedades físico-químicas dependem dos radicais ligados ao átomo de nitrogênio, sendo que as nitrosaminas podem se encontrar nas formas sólida, líquida ou gasosa.

Seu caráter carcinogênico, teratogênico e mutagênico já foi comprovado em testes laboratoriais por mais de 40 espécies de animais, inclusive em macacos. Entretanto, as nitrosaminas, de modo geral, requerem ativação metabólica para exercerem sua ação carcinogênica.Dado seu alto potencial toxicológico, o limite estipulado para presença de nitrosaminas em medicamentos é consideravelmente menor do que as demais impurezas.
Apesar de sua toxicidade, as nitrosaminas são facilmente encontradas em todos os lugares, muitas vezes em porções que não apresentam riscos à saúde humana. Somos expostos a elas basicamente de duas maneiras:
- Exógena: a partir da ingestão de alimentos, o uso de produtos farmacêuticos ou cosméticos e a contaminação ambiental;
- Endógena quando acontece a formação de nitrosaminas a partir de agentes nitrosantes internos ao organismo.
A ingestão de nitritos e compostos N-nitrosos é normalmente baixa, ao contrário da sua formação endógena e da ingestão do seu precursor, o nitrato.
Para saber mais sobre a formação das nitrosaminas, nitrosação, tipos e ativação no organismo continue a leitura! Se quiser outras informações, dê uma olhada nesse artigo.
Os precursores das Nitrosaminas
Nitritos, Nitratos e outros agentes nitrosantes
Nitratos e nitritos são compostos iônicos encontrados na natureza, que fazem parte do ciclo do nitrogênio.O nitrogênio é o elemento químico com maior concentração na atmosfera, porém os animais e as plantas não conseguem absorvê-lo diretamente do ar, sendo fornecido exclusivamente pela dieta no caso dos animais ou da absorção através dos pelos radiculares pelas plantas.
Para ser absorvido o gás nitrogênio (N2) deve ser fixado ao solo, isso ocorre na natureza através de descargas elétricas, fixação biológica através de bactérias de vida livre ou simbióticas, ou através de um processo industrial na produção da uréia.
No solo o nitrogênio na forma de amônio (NH4+) ou amônia (NH3) é rapidamente oxidado a nitrito (NO2–) e posteriormente a nitrato (NO3–) através de bactérias. Apesar da absorção do nitrato, as plantas não conseguem assimilar este composto e produzir biomassa a partir dele, para a assimilação de nitrogênio é necessário que este volte a ser reduzido a amônia. Em nosso corpo, o nitrato também não participa de reações, sendo necessário que ela seja convertida a nitrito.
Nas plantas, após assimilado o nitrato na forma de amônio, este composto deve ser convertido em aminoácidos, o primeiro aminoácido formado é o glutamato, precursor direto da prolina e da arginina, e através de longas e complexas rotas metabólicas os demais 20 aminoácidos são produzidos.
Nos nitratos, o nitrogênio é ligado a três átomos de oxigênio, uma das grandes características dos nitratos é que todos são solúveis em água e pouco reativos. São conhecidos por suas ações vasodilatadoras, sendo essenciais (em pequenas quantidades) no combate ao câncer, diabetes, doenças cardíacas e disfunção erétil. Se a quantidade de nitrato consumida for muito elevada, em algumas condições endógenas, podem levar à formação de nitrosaminas no organismo.
O nitrato é utilizado principalmente na indústria de fertilizantes, herbicidas ou pesticidas. Também é utilizado como agente oxidante na fabricação de explosivos, pólvora, fogos de artifício, como sal de potássio purificado na fabricação de vidro e até mesmo como conservantes de alimentos embutidos.
Já o nitrito, o nitrogênio é ligado a dois átomos de oxigênio, é facilmente oxidado por processos químicos ou biológicos a nitrato, ou reduzido, originando vários compostos. É um composto usado principalmente como aditivo alimentar, especialmente em carnes curadas. O nitrato é algumas vezes adicionado junto com o nitrito como conservante, uma vez que serve como reserva para ele, pois lentamente se transforma em nitrito.
Possíveis fontes de nitrito e outros agentes nitrosantes na industria
Especificamente falando do setor farmacêutico, em geral as fontes de contaminação dede nitrito de sódio (NaNO2) ou outros agentes nitrosantes podem ser:
- Matérias-primas contaminadas (solventes, reagentes, catalisadores) no processo de produção da API (podem formar nitrosaminas em combinação com reagentes, solventes e catalisadores, dos quais as aminas secundárias ou terciárias sejam geradas por reações de degradação, dentro da mesma ou de outra etapa de síntese, caso possa acontecer carry-over).
- Materiais recuperados (solventes, reagentes, catalisadores), principalmente quando reprocessados por terceiros, usando equipamentos não dedicados a esse fim.
- Materiais de partida e intermediários contaminados de fornecedorescujos processos de fabricação ou materiais de partida possam permitir a formação de nitrosamina.
- Contaminação cruzada entre diferentes processos de fabricação na mesma linha de produção que não esteja claramente alocada e erros relacionados ao operador.
- Materiais de embalagem primários, tais como blisters nos quais a película de cobertura nitrocelulósica reage com aminas no primer para pintura usado, gerando nitrosaminas, que seriam transferidas para o produto durante o processo de embalagem.
Aminas (primárias, secundárias, terciárias, aromáticas e alifáticas)
As aminas são bases orgânicas nitrogenadas, obtidas através da substituição de um ou mais hidrogênios da amônia (NH3) por demais grupos orgânicos (alquilas ou arilas). Visto que o nitrogênio é um elemento eletronegativo, atraindo os elétrons com mais força, as moléculas das aminas são polares.
Elas podem se diferenciar em três tipos, variando de acordo com a quantidade de substituintes:
- Amina primária: possui apenas um de seus hidrogênios substituído por um grupo alquila ou arila.
- Amina secundária: possui dois de seus hidrogênios
- Amina terciária: possui seus três hidrogênios substituídos.
Em relação aos tipos de aminas, as primárias e secundárias podem formar ligações hidrogênio com água ou ainda entre si. Já nas amônias terciárias a formação desse tipo de ligação entre si não é possível, já que todos os hidrogênios foram substituídos por radicais orgânicos e como consequência possuem menores pontos de ebulição quando comparados com as primárias e secundárias.
Muitas das características químicas, como ponto de fusão, ebulição e densidade, variam conforme o tamanho e o tipo de cadeia carbônica ligada ao nitrogênio. Quanto maior for a cadeia carbônica dos radicais mais alto será seu ponto de ebulição de fusão. Da mesma forma que radicais de cadeia aberta fazem com que a densidade da Amina seja menor do que quando há radicais aromáticos.
As Aminas podem ser encontradas nos três estados físicos, em condições ideais de temperatura e pressão:
- sólido (mais de 12 carbonos),
- líquido (4 à 12 carbonos) ou
- gasoso (1, 2 ou 3 carbonos).
Elas quase sempre são incolores e possuem um característico cheiro de peixe e podridão, apenas as metilaminas e as etilaminas que possuem um cheiro semelhante à amônia, e seus compostos aromáticos são tóxicos.
Em relação à solubilidade em água, as aminas de baixa massa molecular são bastante solúveis em água, e as demais variam de acordo com o tamanho da cadeia, geralmente moléculas com até cinco carbonos são solúveis em água e álcool, e moléculas de amina com mais de cinco carbonos são insolúveis em água.
As aminas são encontradas em diversas moléculas do cotidiano, são bastante utilizadas na produção de certos tipos de sabões, vulcanização da borracha, produção de sais de amônio (condicionadores para cabelos) e explosivos. Também é bem reconhecida por ter derivações pigmentadoras, servindo como corante tanto para indústria têxtil quanto para indústria de alimentos. São precursoras da vida, estando presente nos aminoácidos. Também são encontradas em vitaminas, fármacos (como antibiótico, anestésicos, antidepressivos) e entorpecentes (alcalóides).
As Nitrosaminas
Nitrosação, processo de formação das nitrosaminas
Os seres humanos podem obter os N-nitrosocompostos de duas maneiras diferentes: por formação endógena, natural no estômago; ou de forma exógena, adquirindo-os a partir de alimentos e medicamentos, devido às técnicas de fabricação ou processamento.
Processo de fornação endóxgena
A formação endógena de compostos N-nitrosos começa quando os nitratos são reduzidos a nitritos por microrganismos da cavidade oral e esses nitritos são posteriormente transformados em óxido nítrico no estômago devido às condições ali existentes.
Em circunstâncias específicas, como gastrite crônica, os nitritos podem ser oxidados no estômago em agentes nitrosantes (N2O3, N2O4) e reagir para formar compostos N-nitrosos. Esta reação ocorre com precursores nitrosáveis, que incluem uma grande variedade de componentes dietéticos, tais como: aminas secundárias encontradas em peixes, ovos, queijos e carnes; precursores naturais nos alimentos como certos aminoácidos, os alcalóides presentes nas especiarias que são usados para curar carnes e conservantes, e outros precursores que aparecem nos alimentos como contaminantes como resíduos de pesticidas, aditivos ou medicamentos.
As nitrosaminas formam-se principalmente no estômago através de uma reação química entre aminas e nitritos, formados a partir dos nitratos. No pH ácido do estômago, geralmente com o pH ótimo entre 2 e 4, dependendo do substrato, forma-se o ácido nitroso (HNO2), por protonação do nitrito, que dimeriza com perda de água, levando à formação de trióxido de dinitrogênio (N2O3), que é a espécie nitrosante.
O N2O3 vai reagir com aminas não protonadas formando uma molécula de nitrosamina, com liberação de HNO2. A formação endógena de nitrosaminas pode também ocorrer através da reação de aminas com produtos do monóxido de nitrogênio (NO) formado durante um processo infeccioso ou inflamatório. Em situações de inflamação, infecção crônica ou dieta altamente proteica, são produzidas quantidades substanciais de NO, que reagem com o oxigênio dissolvido formando N2O3 e N2O4.�
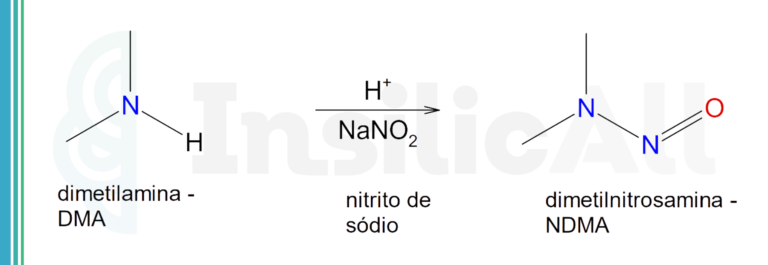
A estrutura final das nitrosaminas será determinada primariamente pela estrutura da amina que foi nitrosada.
As N-nitrosaminas, então, são resultado do excesso de nitrito que se acumula no estômago. Este, proveniente de alimentos, fármacos ou produzido por bactérias locais em excesso, quando em desequilíbrio.
De modo geral, as N-nitrosaminas são estáveis em meios neutros e fortemente básicos.
Ainda que sejam de difícil destruição, elas entram em processo de decomposição lenta quando expostas à radiação UV formando aldeídos, nitrogênio e óxido nitroso, ou aminas e ácido nitroso.
Em meio fortemente ácido ocorre clivagem do grupo nitroso, sendo que a reação pode ser catalisada pela presença de nucleófilos como iodeto, tiocianato, brometo e/ou cloreto. Um reagente comumente utilizado para destruir N-nitrosaminas é o ácido bromídrico em ácido acético glacial.
No estômago, antagonizando a produção de nitrosaminas, alguns ácidos competem com as aminas pelo grupo nitrosante. São alguns deles o ácido sulfâmico, sulfamato de amônio, ácido tânico, alfa tocoferol e ácido ascórbico.
Tipos de Nitrosaminas
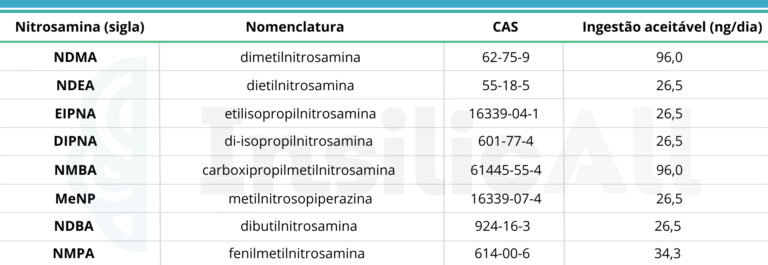
Sob essas moléculas, a ANVISA determinou os limites aceitáveis da presença de nitrosaminas em medicamentos com base nas orientações disponíveis noGuia ICH M7, também aceito pela EMA e FDA. Os limites foram derivados a partir de estudos robustos de carcinogenicidade, considerando risco total de 1:100.000, correspondente ao risco natural, desta forma pode-se considerar como um valor negligenciável.
Historicamente produtos identificados com mais de uma nitrosamina em sua composição tem os seus lotes retirados do mercado, no entanto, diversos produtos podem apresentar mais de uma nitrosamina. Desde que o risco total, ou seja a soma de todas as nitrosaminas, fique dentro da proporção de 1:100.000, o produto continua seguro, podendo ser ajustado a proporção de cada nitrosaminas.
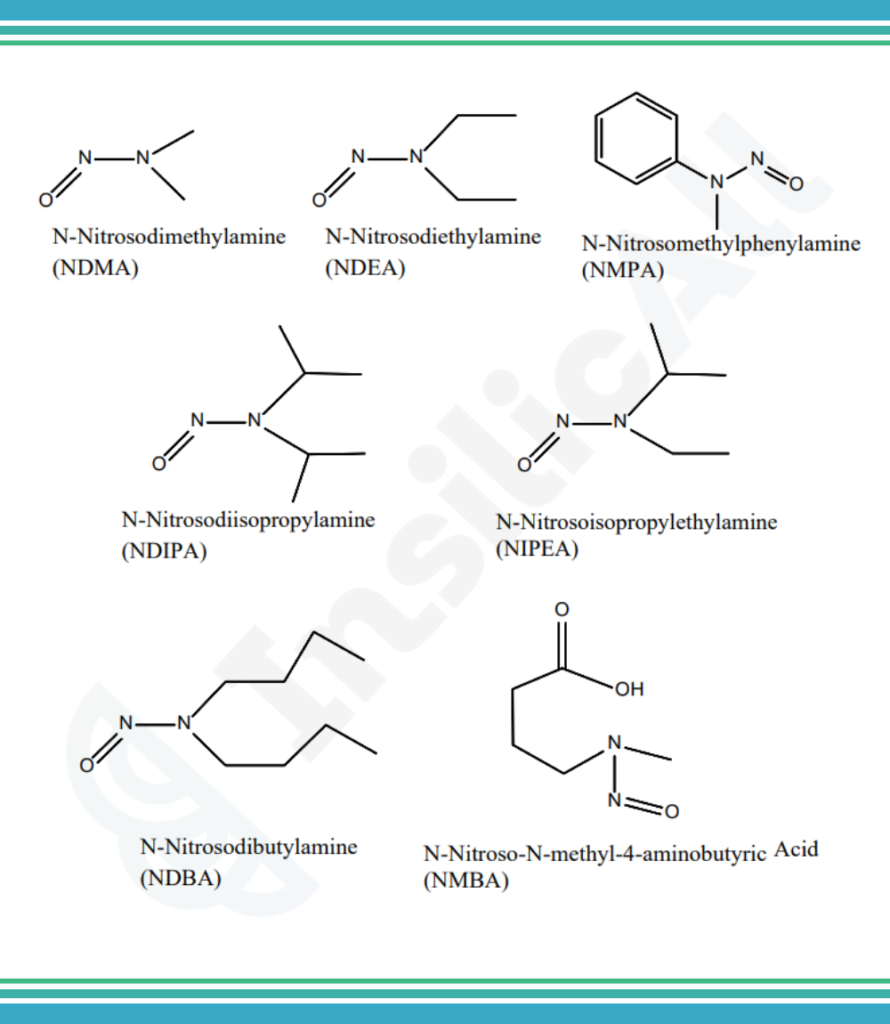
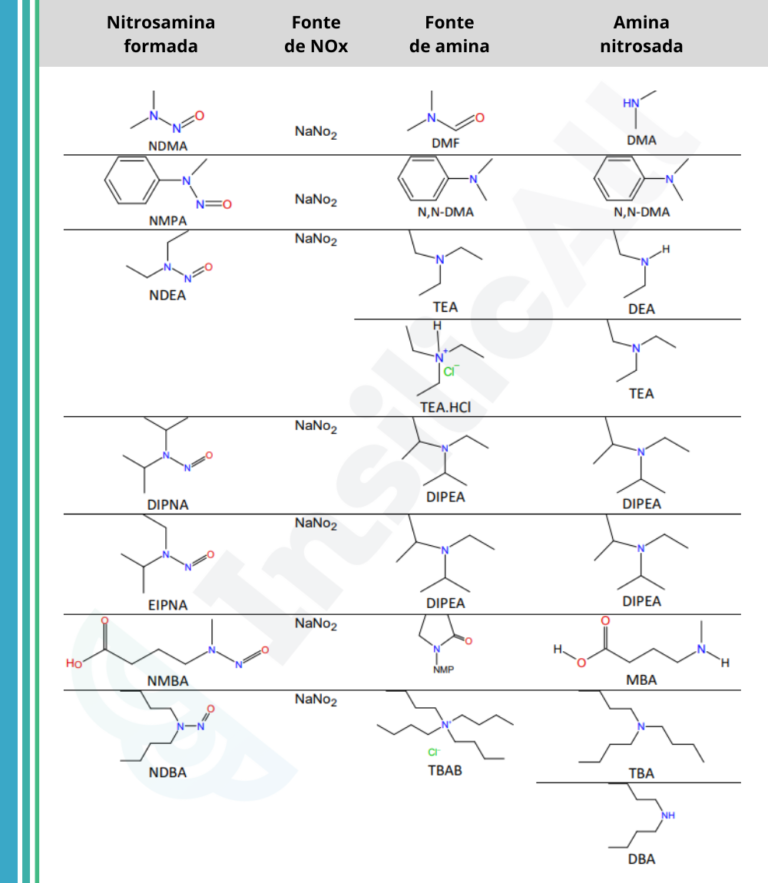
OFDA identificou sete impurezas de nitrosamina que teoricamente poderiam estar presentes em medicamentos:
- N-Nitrosodimetilamina (NDMA);
- N-nitrosodietilamina (NDEA);
- Ácido N-nitroso-N-metil-4-aminobutanóico (NMBA);
- N-nitrosoisopropiletilamina (NIPEA);
- N- nitrosodiisopropilamina (NDIPA);
- N-nitrosodibutilamina (NDBA);
- N-nitrosometilfenilamina (NMPA).
Cinco deles, NDMA, NDEA, NMBA, NIPEA e NMPA, foram realmente detectados em substâncias ou produtos farmacêuticos, segundo o guia publicado pela FDA.
Uma outra opção considera que a soma de todas as nitrosaminas não ultrapasse o limite da nitrosamina mais potente. Os valores abaixo se referem apenas a medicamentos acabados contendo um dos tipos de nitrosamina.
Ativação das Nitrosaminas no corpo humano
As Nitrosaminas não se acumulam no corpo, mas passam por processo de biotransformação no organismo, requerendo ativação metabólica para exercerem sua ação mutagênica e carcinogênica.
Esta etapa é considerada fundamental no processo de iniciação do câncer, sendo que o fígado é o principal órgão de biotransformação das nitrosaminas, mas outros tecidos humanos também as podem biotransformar. A etapa inicial da biotransformação ocorre via ativação do sistema microssomal P-450 (CYP450) pela ação de enzimas.
Envolve uma hidroxilação do carbono do grupo alquila, catalisada pelo Citocromo P450 (principalmente pelo CYP2E1 e possivelmente o CYP2A6) formando um aldeído ou cetona e uma nitrosamina primária, instável, a qual tautomeriza para um alquildiazoidróxido, o qual dá origem a um íon diazônio, que se decompõem levando à formação de carbocátions, que são espécies positivamente carregadas e eletrofílicas capazes de alquilar sítios nucleofílicos do DNA, RNA e proteínas.
A indução de tumores pode ocorrer em diferentes órgãos, dependendo da estrutura química da nitrosamina, da dose, da via de exposição e da espécie animal. Ainda que a indução ao câncer como resultado da exposição às N-nitrosaminas sejam comprovados em animais de laboratório, não existem evidências diretas em humanos, apenas comprovação de sérios danos hepáticos quando expostos à NDMA.
Sobre a InsilicAll
Somos a primeira empresa LATAM que empodera a indústria farmacêutica em seus desafios de drug discovery e em toxicologia regulatória aplicando IA e automação biológica. Com nosso modelo SaaS aumentamos a taxa de sucesso de nossos clientes levando medicamentos inovadores para os pacientes de forma mais rápida e garantindo a segurança toxicológica de sua produção. Nossa missão de entregar a melhor tecnologia com o menor impacto (ESG) nos permite garantir para nossos clientes a otimização de tempo, custos e experimentação animal em seus processos.
Trabalhamos para aumentar a taxa de sucesso em levar medicamentos inovadores para as necessidades dos pacientes, diminuindo o cronograma, os custos e o tempo para que um novo produto chegue à sociedade. Para isso, nossa empresa integra IA, computação e automação biológica para acelerar o design de novas moléculas e proteínas terapêuticas.
Fontes: clique aqui para acessar as fontes utilizadas nesse artigo.








